各種実験動物の性腺刺激ホルモン配列比較
このページでは,各種実験動物の性腺刺激ホルモン配列の比較に関する研究について概説します。
なお,ご質問・ご意見等についてはこちらまでご連絡ください。
背景
現在,多種の実験動物が各々の特性を生かして様々な研究分野で用いられている。 発生工学技術の発展による実験動物の効率的増産技術,凍結保存技術,遺伝子改変技術をこうした実験動物全体に効率よく応用できれば, 科学の発展に大いに寄与するものと考えられる。
発生工学技術を支える技術は多々あるが,発生工学では卵子・胚を対象とするため,卵子・胚の品質向上・入手の効率化は発生工学技術全般の向上をもたらす。その意味で排卵誘起技術(大抵は自然排卵よりも多くの卵子が排卵されるので過排卵誘起と呼ばれることが多い)の改良は発生工学技術の多方面への応用に対する波及効果が高く,慎重に考慮すべき課題であろう。
実験動物の過排卵誘起はホルモン投与によってなされるのが一般的である。最も汎用されるホルモンは妊馬血清性性腺刺激ホルモン(PMSG,eCG)とヒト絨毛性性腺刺激ホルモン(hCG)の組み合わせである。実際,非常に有効なホルモンではあるものの,動物種や系統によって卵胞は発達するが排卵率が低いとか,交尾率に影響するとか,ほとんど効かない例(モルモットなど)などが知られており,馬やヒト由来のホルモン製剤が齧歯類をメインとする実験動物の過排卵誘起に本当に最適なのだろうかという疑問がある。さらに,これらホルモンの選択は「対象動物に適しているから」ではなく,「製剤として入手が容易だから」という理由が大きいのではないだろうか。となれば,もっと対象動物に合ったホルモン製剤を用いるべきではないだろうか。特に近年,リコンビナント製剤等ホルモン製剤としても入手の選択肢が広がっていることから,改めてホルモン製剤の選択基準を考えるべきではないかと考えている。実験動物のほとんどが齧歯目に属するとはいえ,齧歯目内の動物ですら繁殖学的特性は多様であり,ホルモン処理を行うに当たっては各種動物への最適化が必要であろう。
そこで動物種本来の性腺刺激ホルモンのアミノ酸配列との類似性から過排卵誘起処理に使用するホルモン製剤の選択基準が考えられないかと考え, これまでに10種(スナネズミ,ハムスター4種,マストミス,ニホンハタネズミ,モルモット,デグー,ウサギ)の実験動物の性腺刺激ホルモンやその受容体の配列決定を行い, 既報のマウス・ラット,家畜,ヒトの配列との比較を行ってきたので,本ページで紹介する。 本稿では主にリガンド側である性腺刺激ホルモンの比較について述べる。
各種実験動物の系統分類
実験用小動物しては齧歯目とウサギ目が汎用されている。本研究では,齧歯目9種,ウサギは1種であるがLH-βについては3品種を用いた。 なお,マウス・ラットの性腺刺激ホルモンの情報は既報があるので,それらを参照し,本研究では配列決定を行っていない。
| 目 | 亜目 | 科 | 亜科 | 種 | 品種 |
|---|---|---|---|---|---|
| 齧歯目 | リス亜目 | リス科 | (本実験では使用せず) | ||
| ネズミ科 | ハタネズミ亜科 | ニホンハタネズミ Japanese grass vole | |||
| キヌゲネズミ亜科 | シリアンハムスター Syrian hamster | ||||
| アルメニアンハムスター Armenian hamster | |||||
| チャイニーズハムスター Chinese hamster | |||||
| ジャンガリアンハムスター Djungarian hamster | |||||
| アレチネズミ亜科 | スナネズミ Mongolian gerbil | ||||
| ネズミ亜科 | マウス Mouse | ||||
| ラット Rat | |||||
| マストミス Mastomys | |||||
| ヤマアラシ亜目 | テンジクネズミ科 | モルモット Guinea pig | |||
| デグー科 | デグー Degu | ||||
| ウサギ目 | ウサギ科 | ウサギ Rabbit | JW (Japanese White) | ||
| NZW (New Zealand White) | |||||
| Dutch |
なお,ハムスターは別名が多い;例えばシリアンハムスターはゴールデンハムスター Golden hamsterとも呼ばれる。
各種実験動物の繁殖学的特徴
様々な環境に適応・生息する齧歯目動物は,いろいろな繁殖学的戦略をとっており,その様式は一様ではない。
| マウス・ラット | ハムスター類 | ニホンハタネズミ | モルモット | ウサギ | |
|---|---|---|---|---|---|
| 性周期 | 不完全(4~5日) | 不完全(約4日) | 不明瞭 | 完全性周期(約20日) | 連続発情 |
| 排卵 | 自然 | 自然 | 交尾 | 自然 | 交尾 |
| 黄体の活性化 | 交尾刺激 | 交尾刺激 | (交尾?) | 自然に活性化 | (交尾?) |
| リッターサイズ | 大きい | 大きい | 中等度(4匹程度) | 小さい | 大きい |
| 妊娠期間 | 短い(約20日) | 短い(15~18日) | 短い(22~25日) | 長い(約65日) | 中間(約1ヶ月) |
| 新生仔 | 無毛,閉眼 | 無毛,閉眼 | 無毛,閉眼 | 被毛,開眼 | 無毛,閉眼 |
| その他 | 膣閉鎖膜 |
性腺刺激ホルモン gonadotropin
性腺刺激ホルモンは,下垂体で産生・分泌される卵胞刺激ホルモン(FSH, follicle-stimulating hormone)と黄体化ホルモン(LH, luteinizing hormone) 霊長類および馬の胎盤で産生分泌される絨毛性(胎盤性)性腺刺激ホルモン(CG, chorionic gonadotropin)がある。これらホルモンは,甲状腺刺激ホルモン(TSH)とも共通するαサブユニット(Common-α, CGαやα-GSUとも呼ばれる)とホルモン特異的なβサブユニット(FSHβ,LHβ,CGβ)からなるヘテロダイマーである。 今回用いた10種の動物では胎盤性性腺刺激ホルモンは産生されないので下垂体のみを用いた。
Common-αおよびLHβのcDNAは約600塩基(polyAを除く),FSHβ cDNAは3'-非翻訳領域が長い点が特徴で種によってバラツキがあるが1,500~2,000塩基対程度の長さである。 シグナル配列を含むアミノ酸配列は,若干の例外があるが,Common-αが120残基,FSHβが130残基,LHβは143残基である(これらは,Boucefield et al., 1994の総説に詳しい)。
各サブユニットのアミノ酸配列の比較
各種実験動物の各性腺刺激ホルモンサブユニットはRACE法によりcDNA配列を決定し,そのコーディングシーケンスよりアミノ酸配列を決定した。 具体的には各種実験動物の下垂体よりTotal RNAを抽出し,SMART-RACE法(Clontech)によって各種ホルモンのcDNA配列を決定した。 遺伝子特異的プライマーはラットの配列を基本とし,既報のマウス,牛,羊,豚との相同性からプライマー結合部位を選択した。
cDNA配列情報から得たアミノ酸配列を以下に示す。おおむね種間で高い相同性を示すが,細かい点で亜目レベル,亜科レベルを反映したような違いが見られる。
アミノ酸配列の全体的な相同性を見てみると,Common-αは機能的制約がきついせいか,成熟蛋白の相同性が非常に高く,わずかにN末側にバラツキが見られる程度である。FSHβも,種間で非常に相同性が高い。一方,LHβは他の2つのサブユニットに比べ種間のバラツキが大きく,特に受容体結合部位として重要な38-57 loopや93-100 determinant loopにおいて,霊長類とそれ以外では比較的ホモロジーが低いようである。
Common-α (α-GSU, CGα)のアミノ酸配列

Common-αでは成熟蛋白のN末端がリス亜目ではロイシンだが,ヤマアラシ亜目やウサギ,家畜ではフェニルアラニンである。ヒトはアラニンで異なる上,さらに4残基の欠損が見られる。
FSHβのアミノ酸配列
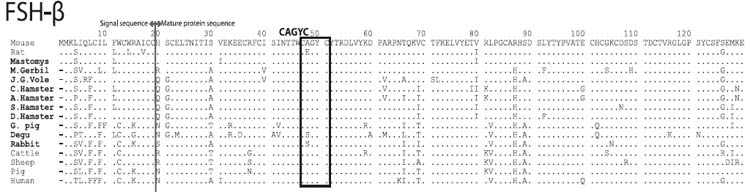
FSHβでは,ネズミ亜科のみシグナル配列のN末のメチオニンが2つ重なっており,一方,成熟蛋白のN末端は亜科レベルで共通性が見られる。
LHβのアミノ酸配列

LHβでは,シグナル配列が豚とデグーで2残基短く,一方,ウサギLHβの成熟蛋白のN末はグルタミンで,おそらくピログルタミル化されているという(Glenn et al., 1984)。確認はしていないが,ハムスターの4種すべてでFSHβの成熟蛋白N末端がウサギLHβと同様グルタミンであり,それゆえピログルタミル化されている可能性がある。
分子系統樹
MEGA3.1ソフトウエア(Kumar et al, 2004)を用いて,JTTモデルに基づき近接結合法により分子系統樹を作成した。
Common-αはヒトを除き比較的まとまっているのに対し,FSHβではリス亜目齧歯類と家畜を両極としてウサギ,ヒト,ヤマアラシ亜目が中間に来る(ただし家畜寄り),LHβではリス亜目齧歯類と霊長類を両極として間にウサギ,家畜,ヤマアラシ亜目が位置することがわかる。
Common-α (α-GSU, CGα)
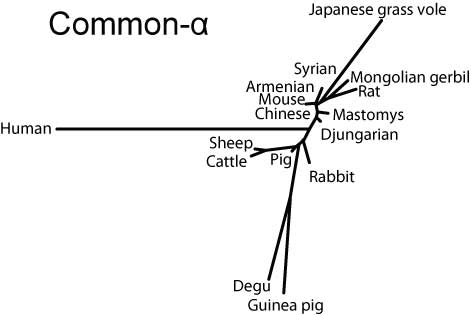 Common-alphaサブユニットの分子系統樹(SVG版)
Common-alphaサブユニットの分子系統樹(SVG版)
FSH-β
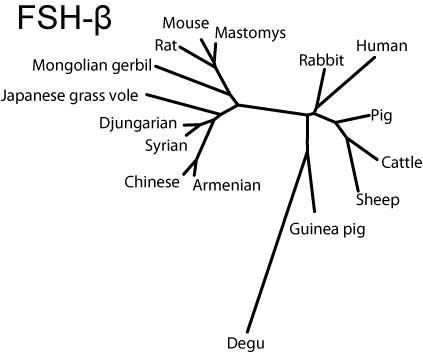 FSH-betaサブユニットの分子系統樹(SVG版)
FSH-betaサブユニットの分子系統樹(SVG版)
LH-β
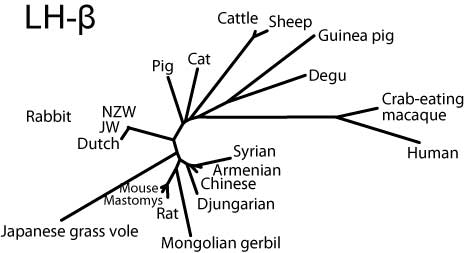 LH-betaサブユニットの分子系統樹(SVG版)
LH-betaサブユニットの分子系統樹(SVG版)
まとめ
これらのことから,ヤマアラシ亜目以外の齧歯類では,ヒトや家畜のホルモンとのホモロジーは低く,何らかの方法でいわゆる「齧歯類型」製剤を作るべきではないか,と感じた。一方,ヤマアラシ亜目の実験動物(モルモットやデグーなど)は,他の齧歯類よりも家畜やヒトに類似し,ヒト製剤の有効性が示唆された。ちなみにモルモットのFSH受容体(AY082514)はヒトの受容体との類似性が高く,ヒトFSH製剤を用いるとモルモットで過排卵を誘起できることを確認している(Suzuki, et al., 2003)。
各種配列のAccession Number
本研究で新規登録した遺伝子配列のAccession Number
| Species | Common-α | FSHβ | LHβ |
|---|---|---|---|
| スナネズミ Mongolian gerbil | AF303351 | AY376457 | AY369077 |
| マストミス Mastomys | AF307149 | AY458603 | AY353073 |
| ニホンハタネズミ Japanese grass vole | AF307150 | AB262180 | AB262179 |
| シリアンハムスター Syrian hamster | AF307148 | AB241062 | AY353074 |
| アルメニアンハムスター Armenian hamster | AB235912 | AB235911 | AB233028 |
| チャイニーズハムスター Chinese hamster | AB248597 | AB248599 | AB248598 |
| ジャンガリアンハムスター Djungarian hamster | AB250761 | AB252645 | AB250762 |
| モルモット Guinea pig | AF257213 | AF257212 | AY373317 |
| デグー Degu | AB262181 | AB262182 | AB262183 |
| ウサギ Rabbit | AF318299 (JW) | AY614704 (JW) | AY614703 (JW) AB235913 (NZW) AB235914 (Dutch) |
既報遺伝子配列のAccession Number
| Species | Common-α | FSHβ | LHβ |
|---|---|---|---|
| マウス Mouse | J00643 | NP_032071 | NM_008497 |
| ラット Rat | V01252 | P18427 | J00749 |
| 豚 Pig | D00767 & D00768 | P01228 | NM_214080 |
| 羊 Sheep | X16977 | P01227 | NM_001009380 |
| 牛 Cattle | X00050 | NP_776485 | NM_173930 |
| ヒト Human | NM000735 | P01225 | NM_000894 |
| 猫 Cat | - | - | NM_001009277 |
| カニクイザル Crab-eating macaque | - | - | AJ781396 |
謝辞
本研究は当研究室と以下の方々との共同研究として行われました:チャイニーズハムスターについては上條信一先生(三菱生命研), ジャンガリアンハムスターについては池 和憲先生(日獣大), デグーに関しては土屋公幸先生(宮崎医大,分与当時)。 ご協力ありがとうございました。
参考文献
一般的な総説として
- Bousfield, G. R., Perry, W. M., Ward, D. N., (1994) Gonadotropins. In Knobil, E., Neill, J. D. (eds.), The physiology of reproduction. 2nd Edition, Raven Press, Ltd., New York, 1749-1792. (2006年にThe physiology of reproductionの第3版が出たが,配列比較の参考には第2版のほうが詳しい)
ウサギのLHβのアミノ酸配列とピログルタミル化について
- Glenn, S. D., Nahm, H. S., Ward, D. N. (1984) The amino acid sequence of the rabbit lutropin beta subunit. J. Protein Chem. 3:259-273.
分子系統樹作成
- Kumar S, Tamura K, Nei M (2004) MEGA3: Integrated Software for Molecular Evolutionary Genetics Analysis and Sequence Alignment Briefings in Bioinformatics 5:150-163.
本研究に関する当研究室の論文
- 鈴木治 (2006) 各種実験動物の性腺刺激ホルモン配列比較と過排卵技術の改良,関西実験動物研究会会報 27:72-75. (本ページはこの論文をベースに作成した)
- Koura, M., Handa, H., Noguchi, Y., Takano, K., Yamamoto, Y., Matsuda, J., Suzuki, O. (2004) Sequence analysis of cDNA encoding follicle-stimulating hormone and luteinizing hormone β-subunits in the Mongolian gerbil (Meriones unguiculatus). Gen. Comp. Endocrinol. 136:406-410.
- Noguchi, Y., Takano, K., Koura, M., Uchio-Yamada, K., Matsuda, J., Suzuki, O. (2006) Sequence analysis of cDNA encoding rabbit follicle-stimulating hormone β-subunit precursor protein. Gen. Comp. Endocrinol. 147:231-235.
- Suzuki, O., Mochida, K., Yamamoto, Y., Noguchi, Y., Takano, K., Matsuda, J., Ogura, A. (2002) Comparison of glycoprotein hormone α-subunits of laboratory animals. Mol. Reprod. Dev. 62:335-342.
- Suzuki, O., Koura, M., Noguchi, Y., Takano, K., Yamamoto, Y., Matsuda, J. (2003) Optimization of superovulation induction by human menopausal gonadotropin in guinea pigs based on follicular waves and FSH-receptor homologies. Mol. Reprod. Dev. 64:219-225.
- Suzuki, O., Koura, M., Noguchi, Y., Takano, K., Uchio-Yamada, K., Matsuda, J. (2007) Analyses of the cDNA and genomic DNA sequences encoding the luteinizing hormone β-subunit precursor protein in the rabbit. Gen. Comp. Endocrinol. 150:514-519.
- Takano, K., Koura, M., Noguchi, Y., Yamamoto, Y., Uchio-Yamada, K., Matsuda, J., Suzuki, O. (2004) Sequence analysis of cDNA encoding follicle-stimulating hormone and luteinizing hormone β-subunits in the Mastomys (Praomys coucha). Gen. Comp. Endocrinol. 138:281-286.